作者:干细胞者说
撰文:步步先生
每个细胞生来就不是平等的,肿瘤干细胞就是肿瘤细胞中的王者。今天,我们回顾一下国际大牛为我们详述的肿瘤干细胞治疗领域的一篇文章。
在生物体内,几乎所有癌症都发生在一些“特殊”的组织和器官里,而这些组织和器官往往包含一种“特殊”的的细胞,这些细胞在生物体一生中均可以有序复制并替代由于衰老或损伤的而丢失的细胞,这些细胞就是“干细胞”。例如:肠道细胞每7天更新一次,而皮肤的表皮细胞是每1个月更新一次。
主流观点认为,癌症是体内细胞多次致癌突变积累而成,那么如果组织中某些可以长期存活的“干细胞”越少,积累的突变自然也就越少,癌症的发生也越来越少。为了搞清楚癌症,我们有必要弄明白干细胞潜在的生物学功能以及如何分化成组织中的成熟细胞。
一篇发表在国际顶级学术期刊 NEJM 上的综述文献为我们详细说明了肿瘤干细胞临床和治疗的潜在价值。作者斯坦福大学干细胞生物学和再生医学研究所副所长Michael Clarke教授的主要研究方向为对正常和肿瘤干细胞自我更新的调控以及肿瘤干细胞的识别。

1
从造血干细胞开始说起
就目前而言,造血干细胞是我们了解最多的成体干细胞,也是真正意义上的干细胞,可自我复制,可多向分化。在1960年,加拿大科学家James Till和Ernest McCullochs首次证实了造血干细胞的存在,即在经骨髓移植后的小鼠脾脏内发现存在有一种具有可自我更新的细胞集落。
这项工作于1960年发表于Radiation Research 杂志。发现了造血干细胞后,我们可以通过小鼠造血干细胞(HSC)的发育概况,来了解一下造血细胞分化等级的经典模型。
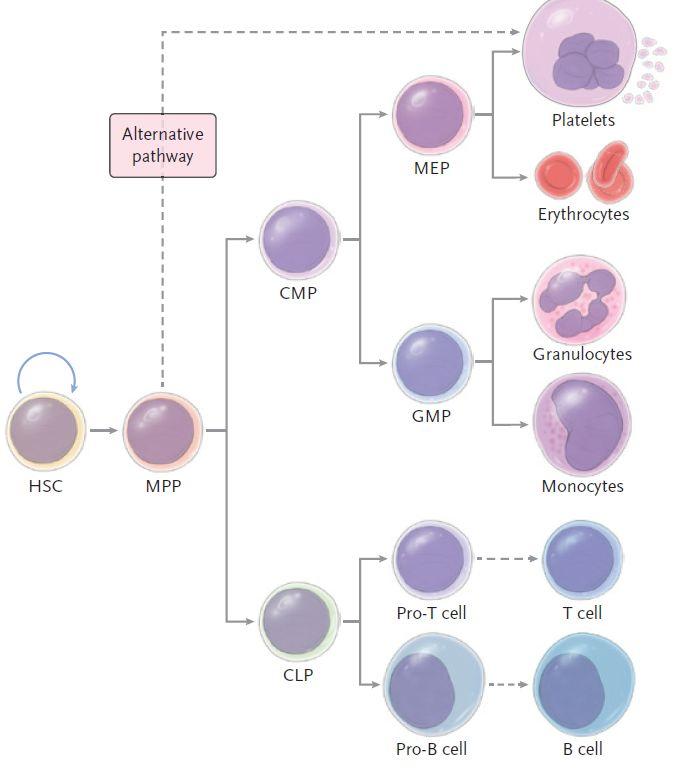
图1. 造血细胞分化等级的经典模型
谈到干细胞的不对称分裂,想必大家都有所了解。当一个造血干细胞分裂成两个子细胞,这两个子细胞还是响当当的造血干细胞,可以继续保持干性,这个过程叫自我更新;而另一个分裂方法是,其中有一个或两个子细胞则开始分化,摇身一变,成为短期造血干细胞或造血祖细胞,最终分化形成很多更下游的造血祖细胞,并向髓系和淋巴系分化,最终分化红细胞、血小板、粒细胞和淋巴细胞等成熟细胞,这个过程叫多向分化。
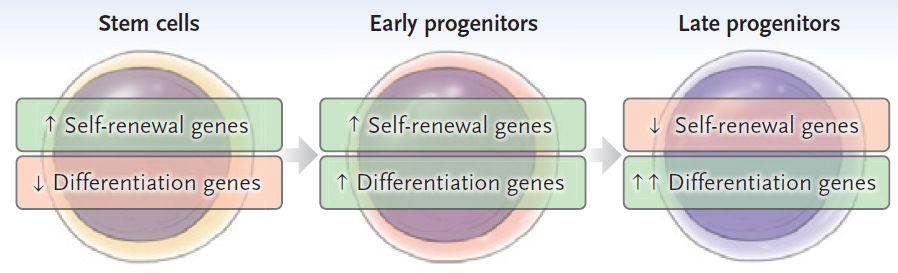
图2.干细胞自我更新和多向化
在干细胞阶段,负责“自我更新”的基因表达占主导地位,干细胞开始复制,体内干细胞数量剧增;在早期祖细胞阶段,负责“自我更新”和“分化”的基因齐头并进,细胞数量和种类增加,不对称分裂主要发生在这一阶段;在晚期祖细胞阶段,负责“分化”的基因开始占表达,干细胞自我复制停止,开始分化。
正是基于干细胞“自我更新”和“分化”的这种特点,仅仅很少数量的造血干细胞就能产生人体一生当中所需的所有血细胞,堪称四两拨千斤。
成体干细胞和已分化的细胞区别主要在于表观遗传构成(DNA甲基化和染色质修饰等)不同。转录因子和miRNA在干细胞的自我更新中发挥着重要作用:例如,染色质修饰因子Bmi1是造血细胞,神经,乳腺和前列腺干细胞自我更新所必需的。
2
肿瘤干细胞打哪里来
大家都知道,正常组织(如皮肤、乳腺、肠道、肺、肝脏,甚至脑)中是存在干细胞的,它们在生物体内特定的龛(niche)持续存在。当其他细胞和组织、器官发生受损、炎症或体内稳态发生变化时,可通过不对称分裂形成下一级祖细胞,并且可在组织中迁移从而修复组织损伤。
许多肿瘤的初始致癌突变(一处或多处)常发生于干细胞。在许多组织中,干细胞是存活最久的细胞,同样,基因突变也是积累最多的。
那么肿瘤干细胞从哪里来的呢?有两种说法:一是,原本潜伏在组织里的成体干细胞发生了变异,变成了肿瘤干细胞;另一种说法是,某些未成熟的祖细胞发生突变后,通过“干细胞”化,变成了“特别坏”的肿瘤干细胞。以造血干细胞为例,如果有几个关键突变共同激活自我更新程序,或者共同使衰老和凋亡程序失活,则它们可赋予早期祖细胞长期增殖能力。因此,肿瘤干细胞最终可能起源于早期祖细胞。
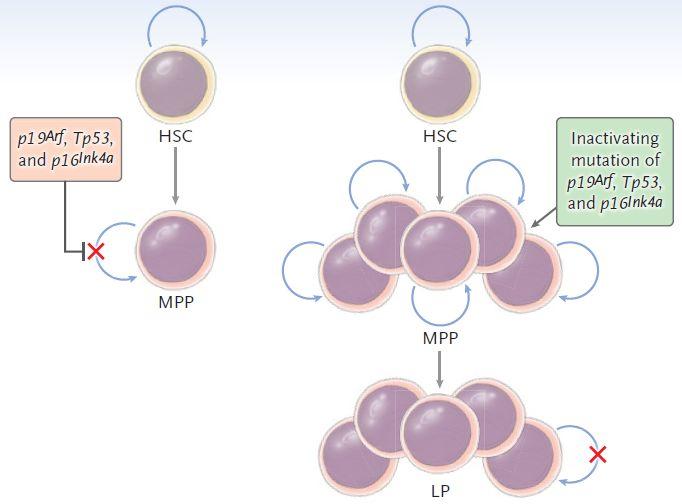
图3. 向早期祖细胞赋予干细胞功能的分子突变
早在20世纪30年代,Furth andKahn (1937) 就将小鼠白血病的细胞种植到同系正常小鼠内,并发现约5%的移植能够成功。
1961年Southam、Brunschwig的研究以及1963年Bruce的研究,初步证明并非每个肿瘤细胞都有再生肿瘤的能力。首次在体内定量了具有克隆形成能力的淋巴瘤细胞的比例,显示大约1%的移植细胞具有克隆形成能力。
1997年,John与 Bonnet首次在白血病中鉴定出肿瘤干细胞,这是在肿瘤干细胞研究领域的一大突破。首次证实了白血病干细胞的存在并明确地提出了“白血病干细胞(leukemia stem cell,LSC)”的概念。
2001 年,Reya在 Nature 上发表文章提出当代肿瘤干细胞学说。
2003 年,Al-Hajj首次从实体瘤组织(乳腺肿瘤)中分离纯化肿瘤干细胞。研究表明,200 个这样的癌细胞便可在受体小鼠体内形成移植瘤。而在相同的培养时间内 ,1 万个非特殊的乳腺癌细胞并不能形成肿瘤。
至此,在血液系统与实体瘤都发现这样一种数量稀少但致瘤性极强的肿瘤干细胞。随后几年内,脑瘤、前列腺癌、肺癌、胰腺癌、鼻咽癌等肿瘤中均发现了肿瘤干细胞,这奠定了肿瘤干细胞理论的研究基础。
2018年来自宾夕法尼亚大学医学院的J. Joseph Melenhorst和免疫治疗学大牛Carl H. June团队(是的,就是CAR-T细胞疗法的奠基人),在顶级国际学术期刊 Nature Medicine 上发表了一个令人震惊的CAR-T细胞治疗后复发的临床案例。这个研究直接证实了人体存在肿瘤干细胞的假说。
3
肿瘤干细胞的临床相关性
在肿瘤干细胞研究领域,存在争议的一个主要问题是肿瘤干细胞是否具有临床相关性。正常干细胞用于维持和调节细胞分化、增殖。而在癌症组织中,组织修复和分化的表观遗传程序遭到破坏。有研究发现,在许多实体瘤中,只有少数癌细胞具有维持形成肿瘤的能力,大多数癌细胞增殖能力有限。因此,深入研究肿瘤干细胞并寻找相应的靶向药物,对癌症的临床治疗意义重大。
然而,很多靶向肿瘤干细胞在临床试验中的药物效果并不理想。这是因为我们对干细胞与肿瘤干细胞还不够了解,原因主要有下面几个:
或者是因为将肿瘤干细胞识别为正常干细胞而不杀伤;
或者是在杀伤时,不能够区别正常干细胞与癌症干细胞,从而产生严重的副作用;
或者是不能区分处于活跃期的肿瘤干细胞和休眠期的肿瘤干细胞,从而无法克服癌症复发等问题。
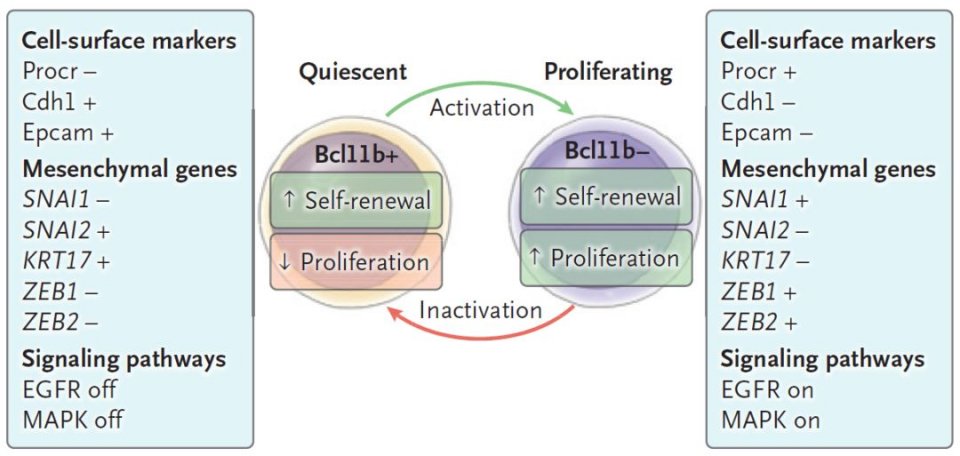
图4.休眠期和活跃期的肿瘤干细胞
FDA批准了三种针对肿瘤干细胞的靶向药。如下诉述,Vismodegib是一种信号通路抑制剂,靶向皮肤基底细胞癌里的肿瘤干细胞亚群,至少一种。Ivosidenib是一种异柠檬酸脱氢酶-1(IDH1)的基因抑制剂,用于治疗复发性白血病,已经获批。Venetoclax,则可增强白血病干细胞里的活性氧(ROS)通路。
通常,干细胞的生物学功能与免疫治疗相关。既然干细胞对于组织损伤的修复十分重要,那么他们可以分泌一些调控因子来躲过自身免疫损伤就不足为奇。同样,以造血干细胞为例,就可以通过表达CD47避免被巨噬细胞吞噬,CD47是有名的“不要吃我”信号。巧合的是,癌细胞也可以表达CD47逃过此劫,真是个擅于学习的坏蛋。
4
肿瘤干细胞的未来展望
肿瘤干细胞的临床转化研究具有光明的前景,虽然目前仅处于起步阶段。如果要想充分发挥肿瘤干细胞的临床潜力,还有以下几个问题需要解决:
首先,也是最重要的基础研究,就是要进一步定义肿瘤组织中正常干细胞和肿瘤干细胞的分子学和细胞学特征。显然,并非所有的致癌突变都可以把干性传递给一个终末细胞,此事定有蹊跷。还要明确肿瘤干细胞的演变的各种通路机制,知己知彼,百战不殆。还需要多种途径联合治疗,多兵种作战,互相配合。
其次,治疗药物要能够针对休眠期和增殖期的肿瘤干细胞,有的放矢,不做无用之功。
最后,治疗要趁早。含有大量突变的肿瘤可能让肿瘤干细胞靶向药物变得更加复杂。如果能在实体瘤早期能够清除掉肿瘤干细胞,那么治疗效果可能更有效。凡事要趁早,不能姑息养奸。
参考资料:
[1] Clarke MF. Clinical and therapeutic implications of cancer stem cells. N Engl J Med 2019;380:2237-45.
[2]McCulloch, E.A., Till, J.E. (1960) The radiation sensitivity of normal mouse bone marrow cells, determined by quantitative marrow transplantation into irradiated mice. Radiation Research 13(1):115–125.
本文转载自其他网站,不代表公司观点和立场。如有内容和图片的著作权异议,请及时联系我们



